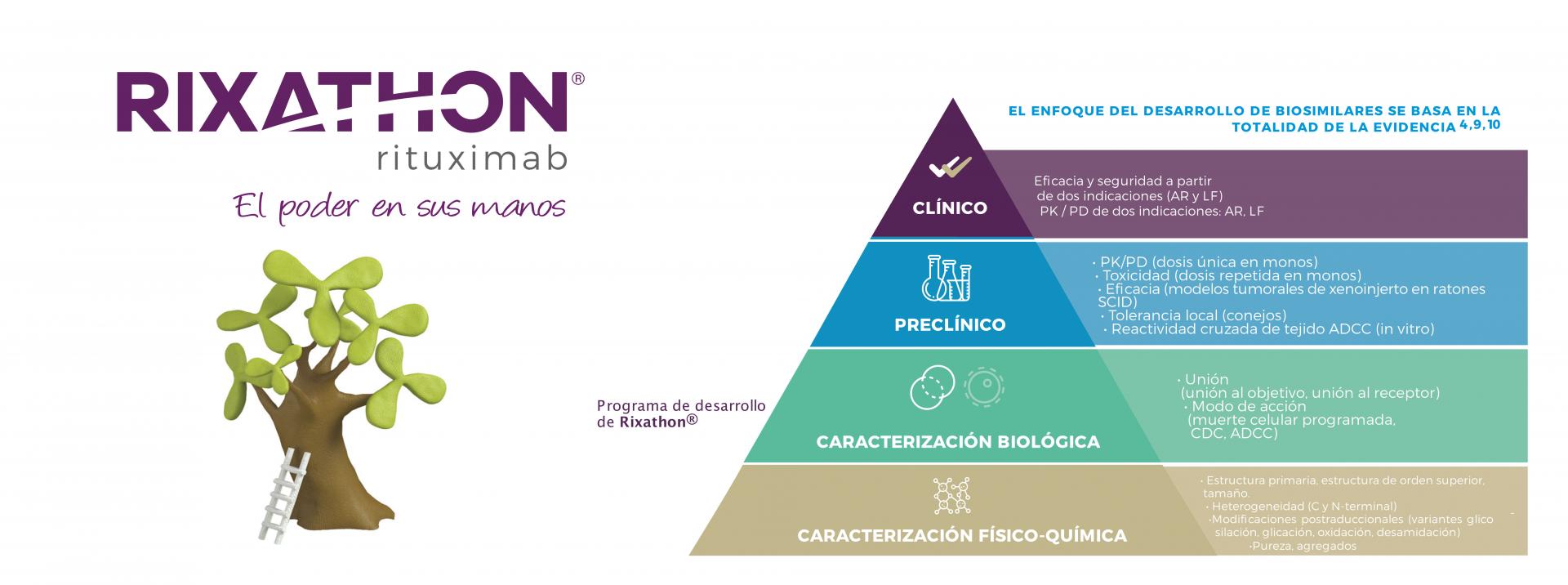
En esta sección podrá acceder al resumen de los estudios pre-clínicos y clínicos que respaldan el desarrollo de Rixathon.
|
|
|
*Si desea tener acceso al estudio completo puede solicitarlo a: [email protected] |
|
|
|
*Si desea tener acceso al estudio completo puede solicitarlo a: [email protected] |
|
|
|
*Si desea tener acceso al estudio completo puede solicitarlo a: [email protected] |
|
|
|
*Si desea tener acceso al estudio completo puede solicitarlo a: [email protected] |
|
|
|
*Si desea tener acceso al estudio completo puede solicitarlo a: [email protected] |